2018年NME由美国食品及药物管理局的批准
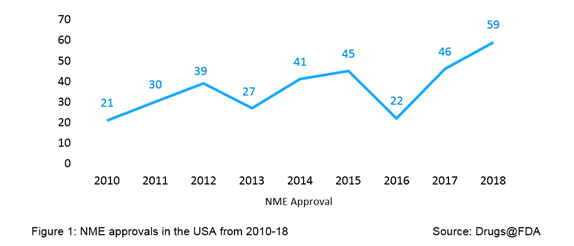
2018是滚动的一年由美国食品及药物管理局批准活动——该机构的药品评价和研究中心(CDER)的批准创纪录数量的59小说药物,被称为新分子实体(nm),以I型加工NDA提交;这个数字是历史上最高的美国食品和药物管理局批准,超过了1996年以前的高53 NME审批。FDA审查的目的,这个术语NME药物批准适用于小说两种新药申请(nda)和原始生物制剂许可证(bla)的应用程序。2018年峰值NME批准量的图,从图1中明显。从2010年到2018年,NME美国FDA批准的平均每年37。
药物创新的一个分水岭
2018年被证明是一个重要的药物创新为NME批准在美国不仅是杰出的数量也为质量,海里有许多突出的例证,袋装的‘第一次’或‘唯一’治疗特定的指示,或被“first-in-class”独特的作用机制,或代表一个新的治疗选择利基组患者几十年来第一次。批准的纪录高点可以归因于利用加快审查程序FDA提供的好处,从而确保早日批准的药物。海里的批准2018年,四分之三(75%)在优先审查批准,总共四个在加速评估批准,大约四分之一(24%)获得突破性治疗名称和大约四分(41%)获得了快速通道的名称。
批准的影响
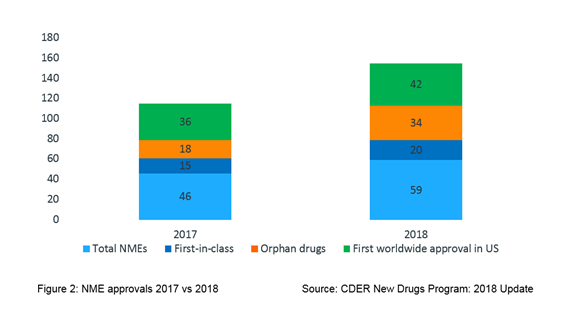
如图2所示,海里的批准2018年,大约有三分之一(20;34%)确定为first-in-class药物,超过一半(34;58%)批准用于治疗一种罕见的疾病和7 10 (42;71%)批准的药物在美国获得全球首次批准。
结论
今年美国食品及药物管理局授予NME批准一个闷热的速度带来许多新的治疗方法,从基础研究到临床应用。各种NME批准将有利于各种患有疾病从罕见疾病常见疾病。上升发展的趋势和批准孤儿药物是显而易见的——有史以来第一次大多数纳米2018年批准用于治疗罕见疾病。美国食品及药物管理局正在以更快的速度在审查提交给监管机构的文件比EMA和批准更多的毒品。2018年,7由美国FDA批准的药物获得批准之前首先在美国在世界其他地方。同时,美国主要是第一目标市场为企业开发和申请批准新型药物与其他国家相比。快速批准可以授权访问新的治疗手段。然而,只有未来几年可以证明增加小说的批准药物的影响是否会转化为更安全、临床和具有成本效益的治疗,证明基于证据的实际好处。
注册的INNsight通讯定期专利,管道和会议更新。
